Struktur Atom
Struktur Atom – Pengantar
Berdasarkan teori atom Dalton, atom merupakan unit dasar terkecil dan tersederhana penyusun suatu unsur. Di dalam atom terdapat partikel subatomik utama: proton, neutron, dan elektron. Proton (p+) yang bermuatan positif dan neutron (n0) yang tidak bermuatan terdapat pada inti atom. Elektron (e−) yang bermuatan negatif bergerak cepat dalam ruang sekeliling inti atom yang sangat besar sebagaimana adanya gaya tarik dari inti atom.
Inti atom sangatlah padat: 99,97% massa atom adalah massa inti atom namun volume yang ditempatinya hanya 1/1015 dari volume atom. Diameter sebuah atom (∼10−10 m) sekitar 100.000 kali diameter inti atom (∼10−15 m). Berikut ilustrasi struktur atom (Gambar 1) dan perbandingan karakter dari 3 partikel subatomik utama (Tabel 1).

Gambar 1. Ilustrasi struktur atom
(Sumber: McMurry, John. et al. 2013. Fundamentals of General, Organic, and Biological Chemistry (7th edition). Illinois: Pearson Education, Inc.)

Nilai massa atom dan partikel-partikel subatomik sangatlah kecil dalam satuan gram sehingga lebih mudah jika dinyatakan sebagai massa relatif. Basis ukuran massa relatif atom adalah atom karbon yang terdiri dari 6 proton dan 6 neutron (atom C-12), di mana massa satu atom C-12 dinyatakan senilai 12 satuan massa atom (sma) atau 12 dalton (Da).
1 sma = 1,660539×10−24 g.
Jadi, secara praktis, massa proton dan massa neutron masing-masing dinyatakan 1 sma.

Gambar 2. Ilustrasi atom dan simbol atom dari beberapa unsur
(Sumber: Silberberg, Martin S. 2009. Chemistry: The Molecular Nature of Matter and Change (5th edition). New York: McGraw Hill)
Isotop, Massa Atom (Massa Atom Rata-rata), dan Massa Atom Relatif
Semua atom dari suatu unsur memiliki nomor atom yang identik, namun memiliki nomor massa yang berbeda-beda. Isotop adalah atom-atom dengan nomor atom yang identik, namun berbeda nomor massa. Sebagai contoh, semua atom karbon (Z = 6) memiliki 6 proton dan 6 neutron, namun di alam 98,89% atom karbon memiliki 6 neutron (A = 12), sisanya 1,11% memiliki 7 neutron (A = 13), dan < 0,01% memiliki 8 neutron (A = 14). Dengan kata lain, di alam terdapat 3 isotop karbon: 12C, 13C, dan 14C. Selain itu, hidrogen juga memiliki 3 isotop – 1H (protium) yang paling berlimpah, 2H (deuterium), dan 3H (tritium).

Gambar 3. Ilustrasi susunan / struktur atom dari ketiga isotop hidrogen: 1H, 2H, dan 3H
(Sumber: McMurry, John. et al. 2013. Fundamentals of General, Organic, and Biological Chemistry (7th edition). Illinois: Pearson Education, Inc.)
Semua unsur yang berada di alam umumnya merupakan campuran dari isotop-isotop. Oleh karena itu, dalam perhitungan perlu diketahui rata-rata dari massa isotop-isotop unsur di alam yang diukur berdasarkan kelimpahan masing-masing isotop tersebut di alam yang disebut massa atom (massa atom rata-rata) unsur. Rumus umum perhitungan massa atom (massa atom rata-rata):
di mana 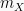 adalah massa atom (massa atom rata-rata) unsur X yang memiliki isotop-isotop dengan massa m1, m2, m3, … dengan kelimpahan masing-masing isotop di alam a1, a2, a3, … dalam fraksi desimal.
adalah massa atom (massa atom rata-rata) unsur X yang memiliki isotop-isotop dengan massa m1, m2, m3, … dengan kelimpahan masing-masing isotop di alam a1, a2, a3, … dalam fraksi desimal.
Contoh Soal Struktur Atom
Perak (Ag; Z = 47) memiliki dua isotop di alam, 107Ag dan 109Ag. Dari data spektrometri massa yang diperoleh berikut, tentukan massa atom Ag.
Isotop Massa (sma) Kelimpahan (%)
107Ag 106,90509 51,84
109Ag 108,90476 48,16
Jawab:
massa atom Ag = (massa isotop 107Ag)(kelimpahan isotop 107Ag) +(massa isotop 109Ag)(kelimpahan isotop 109Ag)
= (106,90509 sma)(0,5184) + (108,90476 sma)(0,4816)
= 55,42 sma + 52,45 sma
= 107,87 sma
Berdasarkan IUPAC, massa atom relatif (Ar) merupakan perbandingan massa atom terhadap satu satuan massa atom (sma), di mana satu sma sama dengan 1/12 massa 1 atom C-12. Jadi, massa atom relatif tidak memiliki satuan.
Isobar dan Isoton
Isobar adalah atom-atom yang memiliki nomor massa yang sama, namun berbeda nomor atom (unsur berbeda).
Contoh:  dengan
dengan  ;
; 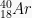 dengan
dengan 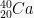 .
.
Isoton adalah atom-atom yang memiliki jumlah neutron sama, namun berbeda nomor atom (unsur berbeda).
Contoh: 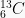 dengan
dengan  ;
;  dengan
dengan 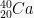
Soal
Pokok teori atom thomson dititikberatkan pada . . . .
A. Atom terdiri dari elektron - elektron
B. Elektron sebagai penyusun utama atom
C. Atom sebagai bola masif yang hanya berisi elektron
D. Atom sebagai bola masif bermuatan positif yang di dalamnya tersebar elektron sehingga keseluruhannya bersifat netral
E. proton dan elektron adalah bagian penyusun atom yang keduanya saling meniadakan.
Pembahasan :
Teori atom Thomson
Atom terdiri dar inti bermuatan positif dan elektron yang menyebar rata di permuakaan atom. Model atom thomson dikenal juga dengan model atom roti kismis.
Jawaban : D
Soal
Teori yang menjadi dasar munculnya teori atom modern adalah . . . .
A. spektrum atom hidrogen
B. tabung sinar katode
C. penghamburan sinar alfa
D. adanya sinar saluran
E. mekanika gelombang
Pembahasan :
Dasar munculnya teori atom modern adalah adanya teori mekanika gelombang yang dikemukakan oleh Heisenberg, Shcrodinger dan de Broglie.
Jawaban : E
Soal
Kelemahan teori atom rutherford adalah tidak adanya penjelasan . . . . .
A. Partikel penyusun inti atom
B. Massa atom yang berpusat pada inti
C. Elektron yang bergerak mengitari inti pada jarak tertentu
D. Inti atom bermuatan positif
E. elektron yang memiliki energi yang tetap
Pembahasan :
Elektron yang tidak melepas dan menyerap energi dijelaskan oleh teori atom Bohr
Jawaban : E
Soal
Penemu neutron adalah . . . .
A. William Crookes
B. Goldstein
C. James Chadwick
D. Sir Humphry Davy
E. J.J Thomson
Pembahasan
Penemu partikel dasar penyusun atom
Neutron = J. Chadwick
Elektron = J.J Thomson
Proton = Goldstein
Jawaban : C
Soal
Partikel bermuatan positif yang terdapat dalam inti atom adalah . . . . .
A. proton
B. inti atom
C. neutron
D. elektron
E. atom
Pembahasan :
Partikel dasar dalam inti atom:
Proton = muatannya positif
Neutron = tidak bermuatan/ netral
Sehingga muatan inti nantinya ditentukan oleh proton yang bermuatan positif.
Soal
A. 16 proton, 14 elektron, 14 neutron
B. 16 proton, 14 elektron, 30 neutron
C. 30 proton, 30 elektron, 16 neutron
D. 16 proton, 16 elektron, 14 neutron
E. 16 proton, 16 elektron, 30 neutron
Pembahasan :
Unsur dengan lambang :
jumlah proton = jumlah elektron = 16
Jumlah neutron = A - Z = 30 - 16 = 14
Jawaban : D
Soal
Notasi yang benar untuk proton, elektron dan neutron adalah . . . .
Pembahasan :
Jawaban : C
Soal
A. P dan Q
B. P dan S
C. Q dan R
D. R dan S
E. P dan R
Pembahasan :
Isoton = dua atom atau lebih yang mempunyai jumlah neutron sama
Jadi yang isoton adalah P dan S
Jawaban : B
Soal
Konfihurasi elektron atom adalah . . . .
A. 2 8 9
B. 2 8 8 1
C. 2 8 18 7
D. 2 8 18 11
E. 2 8 18 8 3
Pembahasan :
Konfigurasi elektron atom adalah :
K L M N
2 8 18 7
Jawaban : C
Soal
Ion di bawah ini yang tidak memiliki konfigurasi elektron sama seperti gas neon adalah . . . . .
Pembahasan :
Ne ( nomor atom 10)
Untuk melihat ion mana yang memiliki konfigurasi elektron yang sama dengan atom Ne, cukup lihat yang mempunayi jumlah elektron yang sama (isoelektronik) dengan Ne.
Soal
A. elektron valensi atom itu adalah 5
B. elektron valensi atom itu adalah 7
C. elektron valensi atom tersebut adalah 10
Pembahasan :
Konfigurasi elektron :
Atau disingkat :
Jumlah elektron valensi = 2 + 5 = 7
Jawaban : B
Soal
Suatu unsur mempunyai konfigurasi elektron :
Yang merupakan kulit valensi unsur tersebut adalah . . . . .
A. 4s
B. 4p
C. 3d
D. 4s, 4p
E. 3d, 4s, 4p
Pembahasan :
Jawaban : D
Soal
A. 1
B. 2
C. 3
D. 4
E. 5
Pembahasan :
Diagram orbital
Orbital yang terdapat pada konfigurasi elektron Ar tentu sudah terisi penuh oleh elektron karena Ar adalah atom golongan gas mulia. Dari diagram orbital diatas, jumlah elektron yang tidak berpasangan ada 3 buah.
Jawaban : C
Soal
A. yang memiliki 1 elektron di kulit terluar
B. yang memiliki 4 elektron di kulit terluar
C. yang memiliki 6 elektron di kulit terluar
D. yang memiliki 7 elektron di kulit terluar
E. yang memiliki 8 elektron di kulit terluar
Pembahasan :
Jumlah elektron ion = 35 + 1 = 36
Konfigurasi elektron
Jumlah elektron valensi = 2 + 6 = 8
Jawaban : E
Soal
Diketahui unsur X dengan nomor atom 24, jumlah elektron maksimum pada orbital d adalah . . . .
A. 3
B. 4
C. 5
D. 6
E. 7
Pembahasan :
X dengan nomor atom 24
Jawaban : C
Soal
Pembahasan :
X nomor atom = 26
Jumlah elektron = 26
Konfigurasi elektron X
atau
Jawaban : E
Soal
Konfigurasi elektron atom X bernomor massa 80 dan memiliki 45 neutron dalam intinya adalah . . . .
Pembahasan :
X memiliki nomor massa 80 dan neutron 45
Jumlah proton = nomor massa - neutron = 80 - 45 = 35
Jumlah proton = Jumlah elektron = Nomor atom
Jawaban : C
Soal
Jumlah elektron maksimum yang dapat mengisi kulit N adalah . . . .
A. 2
B. 10
C. 18
D. 32
E. 54
Pembahasan :
Urutan kulit dalm atom
Kulit K = n = 1
Kulit L = n = 2
Kulit M = n = 3
Kulit N = n = 4
Jumlah maksimum elektron perkulit
= 2 x 16 = 32 buah elektron
Jawaban : D
Soal
Koordinat bilangan kuantum elektron terluar atom 19 K yang benar adalah . . . .
A. (4,0,0,+1/2)
B. (4,0,1,- 1/2)
C. (4,0,0, +1/2)
D. (4,1,1, +1/2)
E. (4,0, 1, +1/2)
Pembahasan :
K dengan nomor atom 19 memiliki konfigurasi
atau
Elektron terluar berada di orbital 4s
Diagram orbital
n = 4
l = 0 (karena sub kulit s)
m = 0
s = +1/2 (arah panah keatas)
Koordinat (4,0, 0, +1/2)
Jawaban : C
Soal
Dalam suatu atom, jumlah maksimum elektron yang memiliki bilangan kuantum n = 4 dan m = 0 adalah . . . .
A. 2
B. 4
C. 6
D. 8
E. 10
Pembahasan :
Bilangan kuantum
n= 4
Ada 4 kemungkinan orbital dengan n= 4 yaitu 4s, 4p, 4d dan 4f.
m = 0 (berarti elektron akan menempati orbital dengan nilai m = 0)
Jumlah maksimum elektron = 8 elektron
Jawaban : D
Soal
Urutan pengisian elektron ke dalam satu subkulit dimulai dengan elektron menempati seluruh orbital dengan spin sama, selanjutnya baru berpasangan. Aturan ini dinyatakan oleh . . . .
A. Hund
B. Pauli
C. Aufbau
D. Niels Bohr
E. Goudsmit
Pembahasan :
Untuk teori yang lebih lengkap silahkan kunjungi link berikut ini : Aturan Konfgurasi Elektron
Jawaban : A
Soal
Bilangan kuantum spin menyatakan . . . . .
A. Orbital suatu atom
B. Bentuk - bentuk subkulit
C. Arah ruang suatu orbital
D. Perbedaan tingkat energi Kulit
E. Perbedaan arah rotasi elektron
Pembahasan :
Bilangan kuantum spin adalah bilangan yang menunjukkan arah rotasi elektron dalam orbital yang berlawanan. Informasi lebih lengkanp silakhan kunjungi : Bilangan Kuantum
Soal
Harga m yang dimiliki oleh subkulit d mempunyai kisaran harga . . . .
A. - 1 sampai + 1
B. - 2 sampai + 2
C. - 3 sampai + 3
D. - 4 sampai + 4
E. - 5 sampai + 5
Pembahasan :
Subkulit d memiliki :
Harga l = 2
Harga m = - 2, -1, 0 + 1, +2
Jawaban : B
Soal
Jumlah orbital unsur X dengan nomor atom 20 adalah . . . .
A. 8
B. 10
C. 13
D. 14
E. 15
Pembahasan :
X dengan nomor atom 20
Diagram orbital
Jumlah orbital = 1 + 1 + 3 + 1 + 3 + 1 = 10 orbital
Jawaban : B
Soal
Perhatikan tabel pengisian elektron - elektron ke dalam subkulit!
Pengisian elektron yang benar menurut aturan Aufbau dan Hund yaitu . . . . .
A. I dan V
B. I dan II
C. II dan V
D. III dan V
E. IV dan V
Pembahasan :
I
II
III
IV
V
Jawaban : D
Soal
A. 8
B. 9
C. 11
D. 18
E. 21
Pembahasan :
Kulit K = = 2 elektron
Kulit L = = 8 elektron
Kulit M = = 11 elektron
Kulit N = = 2 elektron
Jawaban : C
Soal
A. n = 2, l = 0, m = 0, s = - 1/2
B. n = 2, l = 1, m = +1, s = - 1/2
C. n = 3, l = 0, m = 0, s = + 1/2
D. n = 3, l = 1, m = -1, s = + 1/2
E. n = 3, l = 2, m = 0, s = + 1/2
Pembahasan :
jumlah elektron = 10
Jumlah elektron atom X mula - mula = 10 + 3 = 13 elektron
Konfigurasi elektron atom X =
Jawaban : D
Soal
Elektron terakhir atom X memiliki 4 bilangan kuantum sebagai berikut.
n = 4, l = 0, m = 0, s = +1/2
Nomor atom x adalah . . . .
A. 19
B. 20
C. 28
D. 37
E. 45
Pembahasan :
Berdasarkan 4 bilangan kuantum yang diketahui, maka elektron terakhir atom X terletak pada sub kulit .
Diagram orbital :
Konfigurasi elektronnya adalah :
Jika dihitung, jumlah elektronnya adalah 19 buah
Jawaban : A
Soal
A. 28
B. 31
C. 56
D. 60
E. 63
Pembahasan :
(elektron yang dilepas adalah elektron yang berada pada sub kulit 4s dan 3d).
Jumlah elektron atom X = 23 + 3 = 26
e = p = 26, maka
Nomor massa = p + n = 26 + 30 = 56
Jawaban : C
Judul Artikel: Struktur Atom
Kontributor: Nirwan Susianto, S.Si.
Referensi
– Brown, Theodore L. et al. 2015. Chemistry: The Central Science (13th edition). New Jersey: Pearson Education, Inc.
– Cracolice, Mark S. & Peters, Edward I. 2011. Introductory Chemistry: An Active Learning Approach (4th edition). California: Brooks/Cole, Cengage Learning.
– Earl, Bryan & Wilford, Doug. 2014. Cambridge IGCSE® Chemistry (3rd edition). London: Hodder Education.
– Gilbert, Thomas N. et al. 2012. Chemistry: The Science in Context (3rd edition). New York: W. W. Norton & Company, Inc.
– McMurry, John. et al. 2013. Fundamentals of General, Organic, and Biological Chemistry (7th edition). Illinois: Pearson Education, Inc.
– Petrucci, Ralph H. et al. 2011. General Chemistry: Principles and Modern Applications (10th edition). Toronto: Pearson Canada Inc.
– Purba, Michael. 2006. Kimia 1A untuk SMA Kelas X. Jakarta: Erlangga.
– Silberberg, Martin S. 2009. Chemistry: The Molecular Nature of Matter and Change (5th edition). New York: McGraw Hill














0 komentar:
Posting Komentar